|
Termodinâmica
 Introdução Introdução
 Lei Zero Lei Zero
 Gáz Ideal Gáz Ideal
 Termômetro Padrão Termômetro Padrão
 Processos Reversíveis Processos Reversíveis
 Trabalho de Expansão
Introdução Trabalho de Expansão
Introdução
A
termodinâmica
estuda
como
as
trocas
de
energia
com
a
vizinhança
afetam
o
comportamento
de
um
sistema.
Isto
é
feito
sem
considerar
as
propriedades
específicas
das
partículas
que
constituem
esse
sistema.
Como
tal,
várias
grandezas
físicas
de
natureza
macroscópica,
como
a
energia
trocada
no
processo
chamado
calor,
a
energia
trocada
no
processo
chamado
trabalho,
a
entropia
e
a
capacidade
térmica,
entre
outras
que
podem
ser
medidas
experimentalmente,
são
introduzidas
sem
se
relacionarem
diretamente
com
a
estrutura
interna
do
sistema.
Por
isso,
os
métodos
e
resultados
da
termodinâmica
têm
caráter
extremamente
geral.
|
Lei Zero
Um
sistema
está
isolado
quando
contido
por
paredes
adiabáticas,
ou
seja,
quando
não
pode
trocar
energia
na
forma
de
calor
com
a
vizinhança.
É
um
fato
experimental
que
um
sistema
isolado
sempre
tende
a
um
estado
de
equilíbrio
térmico,
isto
é,
um
estado
para
o
qual
as
variáveis
macroscópicas
que
o
caracterizam
não
mudam
com
o
tempo.
Quando
dois
sistemas
estão
separados
por
uma
parede
diatérmica
dizemos
que
estão
em
contato
térmico.
Colocando
em
contato
térmico
dois
sistemas
que,
isoladamente,
estavam
em
equilíbrio
térmico,
observam-se
mudanças
em
suas
variáveis
macroscópicas
até
que
alcancem
novos
valores
que
permanecem
constantes
com
o
tempo.
Dizemos,
então,
que
os
dois
sistemas
estão
em
equilíbrio
térmico
um
com
o
outro.
O
conceito
de
temperatura
está
associado
ao
seguinte
fato
experimental,
conhecido
como
lei
zero
da
termodinâmica:
dois
sistemas
em
equilíbrio
térmico
com
um
terceiro
estão
em
equilíbrio
térmico
ente
si.
Assim,
dois
sistemas
em
equilíbrio
térmico
entre
si
estão
à
mesma
temperatura.
Para
saber
se
dois
sistemas
têm
a
mesma
temperatura
não
é
necessário
colocá-los
em
contato
térmico
entre
si,
bastando
verificar
se
ambos
estão
em
equilíbrio
térmico
com
um
terceiro
corpo,
chamado
termômetro.
Na
prática,
um
termômetro
pode
ser
construído
como
segue.
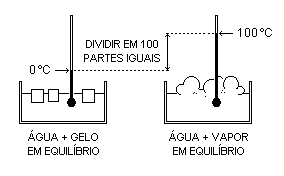
Escolhe-se
uma
substância
termométrica.
Por
exemplo,
o
mercúrio.
Escolhe-se,
desta
substância,
uma
propriedade
que
dependa
da
percepção
fisiológica
de
temperatura.
Por
exemplo,
o
volume.
Define-se
a
escala
de
temperatura.
A
escala
Celsius,
por
exemplo,
é
definida
por
dois
pontos
fixos
e
uma
lei
linear.
As
leis
físicas
são
expressas
por
equações
matemáticas
mais
simples
se
a
temperatura
é
dada
na
escala
Kelvin:
T[K]
=
273
+
t[oC]
Gás Ideal
O
estado
de
um
gás
ideal
fica
definido
pelas
variáveis
macroscópicas:
pressão
(P),
volume
(V)
e
temperatura
Kelvin
(T).
As
variáveis
pressão
e
temperatura
representam
valores
médios
de
grandezas
microscópicas.
A
pressão
está
relacionada
com
o
valor
médio
da
quantidade
de
movimento
transferida
das
partículas
às
paredes
do
recipiente
nas
colisões.
A
temperatura
está
relacionada
com
a
energia
cinética
média
das
partículas.
A
relação
matemática
entre
estas
variáveis
é
chamada
equação
de
estado.
Gás
ideal
é
aquele
para
o
qual
vale
a
equação
de
estado
(de
Clapeyron):
PV
=
nRT
para
quaisquer
valores
de
P
e
T.
Aqui,
n
é
o
número
de
mols
da
substância
em
questão
e
R,
a
constante
universal
dos
gases.
Lei
de
Charles
Para
uma
transformação
isovolumétrica
(a
volume
constante):
P
/
T
=
constante
Assim,
para
uma
dada
massa
de
gás
mantido
o
volume
constante,
a
pressão
é
diretamente
proporcional
à
temperatura
absoluta.
Lei
de
Gay-Lussac
Para
uma
transformação
isobárica
(a
pressão
constante):
V
/
T
=
constante
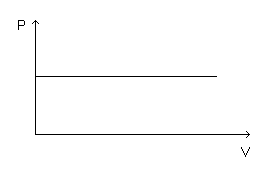
Assim,
para
uma
dada
massa
de
gás
mantida
a
pressão
constante,
o
volume
é
diretamente
proporcional
à
temperatura
absoluta.
Lei
de
Boyle-Mariotte
Para
uma
transformação
isotérmica
(a
temperatura
constante):
PV
=
constante
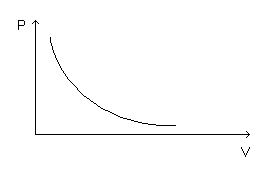
Assim,
para
uma
dada
massa
de
gás
mantida
a
temperatura
constante,
a
pressão
é
inversamente
proporcional
ao
volume
ocupado.
 Têrmometro Padrão
Têrmometro Padrão
Os
valores
atribuídos
à
temperatura
de
um
sistema
qualquer
dependem
do
termômetro
usado,
mesmo
que
todos
concordem
nos
pontos
fixos
que
definem
a
escala
usada.
Existe,
portanto,
a
necessidade
de
escolher
um
termômetro
padrão,
pelo
menos
para
uso
científico.
O
termômetro
escolhido
como
padrão
é
o
termômetro
de
gás
a
volume
constante.

Um
gás
enche
um
bulbo
e
um
capilar
ligado
a
um
manômetro
de
tubo
aberto
com
mercúrio.
O
bulbo
é
colocado
em
contato
térmico
com
o
sistema
cuja
temperatura
se
quer
determinar.
Um
tubo
flexível
permite
levantar
ou
abaixar
um
reservatório
com
mercúrio,
fazendo
com
que
o
mercúrio
no
ramo
esquerdo
do
manômetro
coincida
sempre
com
o
zero
da
escala.
Assim,
o
volume
do
gás
pode
ser
mantido
constante,
apesar
do
aumento
ou
diminuição
da
sua
temperatura.
Neste
termômetro,
a
propriedade
termométrica
é
a
pressão
do
gás.
Medindo-se
h,
o
desnível
do
mercúrio
no
manômetro,
e
conhecendo-se
o
valor
da
pressão
atmosférica,
PA,
o
módulo
da
aceleração
da
gravidade,
g,
e
a
densidade
do
mercúrio,
r,
a
pressão
do
gás
no
bulbo
é
determinada
por:
P
=
PA
+
rgh
A
temperatura
do
gás
e,
portanto,
do
sistema
em
questão,
é
definida
em
função
de
um
ponto
fixo,
o
ponto
triplo
da
água,
por:
T(P)
=
273,16
[
P
/
PT
]
K
onde
PT
é
a
pressão
do
gás
quando
em
contato
com
a
água
no
ponto
triplo.
O
ponto
triplo
representa
o
estado
em
que
coexistem,
em
equilíbrio,
as
fases
líquida,
sólida
e
gasosa
da
água.
Para
esse
estado,
P
=
4,58
mmHg
e
T
=
0,01
oC.
Na
prática,
mede-se
PT
e
P
para
quantidades
cada
vez
menores
de
gás
(ou
seja,
para
PT
tendendo
a
zero)
e
a
temperatura
é
tomada
como
o
resultado
desse
processo
de
limite.
A
escala
de
temperatura
assim
definida
depende
apenas
das
propriedades
gerais
dos
gases
e
não
das
propriedades
de
um
gás
particular.
Como
os
gases
reais
se
comportam
como
ideais
no
limite
de
baixas
pressões,
esta
escala
é
chamada
de
escala
termométrica
de
gás
ideal.
Então,
o
termômetro
usada
como
padrão
é
o
termômetro
de
gás
a
volume
constante
com
a
escala
termométrica
de
gás
ideal.
A
escala
escolhida
desta
maneira
independe
das
propriedades
de
qualquer
gás
em
particular,
mas
depende
das
propriedades
dos
gases
ideais.
A
escala
termométrica
absoluta
Kelvin
independe
das
propriedades
de
qualquer
substância.
A
escala
Kelvin
e
a
escala
de
gás
ideal
são
idênticas
no
intervalo
de
temperatura
em
que
o
termômetro
de
gás
pode
ser
usado.
Processos Reversíveis
Se um sistema experimenta
um
processo
espontâneo
que
o
leva
de
um
estado
de
equilíbrio
a
outro,
os
estados
intermediários
não
são
estados
de
equilíbrio.
Contudo,
se
o
processo
é
efetuado
lentamente,
desenvolvendo-se
em
pequenas
etapas,
a
cada
nova
perturbação
o
sistema
não
se
afasta
apreciavelmente
do
estado
de
equilíbrio
e
tem
tempo
de
atingir
um
novo
estado
de
equilíbrio
antes
de
outra
perturbação.
Então,
em
qualquer
instante
dado,
o
estado
do
sistema
está
próximo
de
um
estado
de
equilíbrio.
Um
processo
efetuado
muito
lentamenteé
e
em
etapas
infinitesimais
é
chamado
quase-estático
e
pode
ser
considerado
como
uma
sucessão
de
estados
de
equilíbrio.
Se,
além
de
ser
quase-estático,
o
processo
puder
ser
invertido
por
variações
infinitesimais
em
qualquer
propriedade
do
sistema,
este
processo
também
é
reversível.
Em
outras
palavras,
o
processo
é
reversível
se
pode
ser
invertido,
com
o
sistema
passando
pelos
mesmos
estados
(de
equilíbrio)
intermediários,
na
ordem
inversa.
A
importância
dos
processos
reversíveis
reside
nos
seguintes
fatos.
O
trabalho
de
um
gás
sobre
a
sua
vizinhança
numa
expansão
adiabática
é
máximo
quando
o
processo
é
reversível.
E
inversamente,
o
trabalho
da
vizinhança
sobre
o
sistema
numa
compressão
adiabática
é
mínimo
quando
o
processo
é
reversível.
Para
discutir
um
exemplo
de
processo
reversível,
consideremos
um
gás
confinado
a
um
cilindro
por
um
pistão
móvel
sem
atrito.
O
cilindro
e
o
pistão
isolam
termicamente
o
gás
da
sua
vizinhança.
O
gás
é
comprimido
quase-estaticamente
colocando-se
grãos
de
areia
sobre
o
pistão,
um
a
um
e
lentamente.
O
processo
é
reversível
porque
pode
ser
invertido
retirando-se
os
grãos
de
areia,
um
a
um,
lentamente
e
na
ordem
inversa
de
sua
colocação.
Caso
exista
atrito
entre
o
cilindro
e
o
pistão,
este
só
pode
ser
colocado
em
movimento
por
um
certo
número
mínimo
de
grãos
de
areia.
Assim,
o
processo
de
compressão
não
pode
ser
quase-estático
nem
reversível.
E
se
o
pistão
já
está
em
movimento
lento,
comprimindo
o
gás
com
a
colocação
lenta
de
grãos
de
areia,
esse
movimento
só
pode
ser
invertido
com
a
retirada
de
um
certo
número
mínimo
de
grãos
de
areia.
Assim,
o
processo
pode
ser
quase-estático,
mas
não
pode
ser
reversível.
O
processo
de
transferência
de
energia
na
forma
de
calor
de
um
corpo
a
uma
dada
temperatura
para
outro,
a
temperatura
menor,
é
irreversível
porque
ocorre
espontaneamente
em
um
único
sentido.
Também
é
irreversível
qualquer
processo
que
converta
energia
mecânica
em
energia
interna.
Por
exemplo,
quando
dois
objetos
em
contato
são
movidos
um
em
relação
ao
outro,
o
atrito
faz
com
que
energia
mecânica
se
transforme
em
energia
interna
(a
temperatura
dos
corpos
se
eleva).
O
processo
inverso,
isto
é,
a
transformação
do
excesso
de
energia
interna
em
energia
mecânica,
não
pode
ser
realizado
porque
a
vizinhança
não
volta
ao
seu
estado
original.
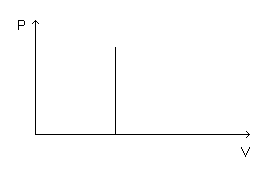
Como
qualquer
estado
de
equilíbrio
termodinâmico
de
um
fluido
homogêneo,
por
exemplo,
fica
definido
por
duas
variáveis,
podemos
representa-lo
por
um
ponto
no
plano
P-V.
E
uma
transformação
reversível
pode
ser
representada
por
uma
curva
nesse
plano,
já
que,
então,
o
sistema
passa
por
uma
sucessão
de
estados
de
equilíbrio.
Trabalho de Expansão
Consideremos um certo sistema cujo volume sofre uma
variação
muito
pequena,
passando
de
V
para
V
+
DV,
sob
o
efeito
de
uma
pressão
externa
PE.

A
força
externa
que
atua
sobre
um
elemento
de
superfície
da
fronteira
do
sistema
de
área
DA
é:
DFE
=
-
PE
DA
e
se
esse
elemento
de
superfície
sofre
um
deslocamento
Ds,
o
trabalho
desta
força
externa
sobre
ele
é:
D2
WE
=
DFEDs
=
-
PE
DA
Ds
Quando
todos
os
elementos
de
superfície
são
incluídos,
o
trabalho
das
forças
externas
(da
vizinhança)
sobre
o
sistema
é
dado
pela
soma
de
D2
WE
sobre
toda
a
superfície
de
área
A,
resultando:
DWE
=
-
PE
DV
Esta
expressão
dá
o
trabalho
da
vizinhança
sobre
o
sistema
quando
o
volume
do
sistema
sofre
uma
variação
muito
pequena
DV.
O
trabalho
da
vizinhança
sobre
o
sistema
é
positivo
quando
DV
<
0,
ou
seja,
quando
o
sistema
se
contrai.
O
trabalho
da
vizinhança
sobre
o
sistema
é
negativo
quando
DV
>
0,
ou
seja,
quando
o
sistema
se
expande.
Quando
a
variação
de
volume
do
sistema
é
finita,
pode-se
pensar
que
ela
se
dá
por
uma
série
de
etapas,
cada
qual
associada
a
uma
variação
de
volume
muito
pequena.
Então,
o
trabalho
total
da
vizinhança
sobre
o
sistema
é
a
soma
dos
trabalhos
associados
a
cada
etapa:
WE
=
-
S
PE
DV
Por
outro
lado,
pela
terceira
lei
de
Newton,
as
forças
externas
que
atuam
sobre
o
sistema
são
iguais
em
módulo
e
direção,
mas
de
sentido
contrário,
às
forças
do
sistema
sobre
a
vizinhança.
Assim,
podemos
escrever,
para
o
trabalho
do
sistema
sobre
a
vizinhança,
quando
o
volume
do
sistema
sofre
uma
variação
muito
pequena
DV:
DW
=
-
DWE
=
PE
DV
Agora,
caso
o
processo
de
variação
de
volume
do
sistema
seja
reversível,
tem
sentido
falar
na
pressão
P
do
sistema,
com
P
=
PE.
Então:
DW
=
P
DV
Esta
expressão
dá
o
trabalho
do
sistema
sobre
a
vizinhança
quando
o
volume
do
sistema
sofre
uma
variação
muito
pequena
DV.
O
trabalho
do
sistema
sobre
a
vizinhança
é
positivo
quando
DV
>
0,
ou
seja,
quando
o
sistema
se
expande.
O
trabalho
do
sistema
sobre
a
vizinhança
é
negativo
quando
DV
<
0,
ou
seja,
quando
o
sistema
se
contrai.
Para
uma
transformação
reversível
finita
no
volume
do
sistema:
W
=
S
P
DV
A
relação
entre
a
pressão
e
o
volume
(dada
pela
equação
de
estado)
de
um
sistema
que
se
transforma
reversivelmente
pode
ser
representada
por
uma
curva
no
plano
P-V.
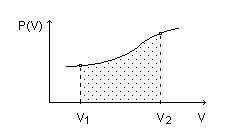
A
área
entre
a
curva
e
o
eixo
OV,
de
V1
até
V2,
representa
o
trabalho
do
sistema
contra
a
vizinhança
numa
expansão
de
V1
até
V2.
A
partir
dessa
interpretação
geométrica
para
o
trabalho
podemos
ver
claramente
que
o
mesmo
depende
do
processo
que
liga
os
estados
inicial
e
final,
já
que
então
a
área
correspondente
deve
ser
diferente.
Para
um
processo
de
expansão
isobárico
reversível:
W
=
P
(
V2
-
V1
)
e
caso
o
sistema
seja
um
gás
ideal:
W
=
nR
(
T2
-
T1
)
Para
um
processo
de
expansão
isotérmico
reversível
de
um
gás
ideal:
W
=
nRT
ln
(
V2
/
V1
)
 Autor:
Adriano
Pasqualotti
Autor:
Adriano
Pasqualotti
Fonte:
http://usuarios.upf.br/~pasqualotti/hiperdoc/concreto.htm
|
